En los últimos años, el campo de la biomedicina ha sido testigo de avances revolucionarios en el desarrollo de terapias innovadoras para una amplia gama de enfermedades
Entre estas innovaciones, el desarrollo de terapias con oligonucleótidos ha experimentado un gran desarrollo y en concreto el campo de las terapias antisentido con ejemplos tan paradigmáticos como la aprobación de varios fármacos contra enfermedades raras como la amiloidosis hereditaria, la porfiria hepática aguda, o la distrofia muscular de Duchenne. Un ejemplo concreto de terapia antisentido consiste en la inhibición de la expresión de microRNAs.
Los microRNAs (miRNAs) son pequeñas moléculas de RNA no codificante que juegan un papel crucial en la regulación de la expresión génica. Actúan uniéndose a moléculas de RNA mensajero (mRNA) y, según el contexto, pueden inhibir la traducción de proteínas o facilitar la degradación del mRNA. Esta capacidad de regulación convierte a los miRNAs en elementos fundamentales para el mantenimiento de diversas funciones celulares. Sin embargo, cuando los niveles de ciertos miRNAs están desregulados, pueden contribuir al desarrollo de enfermedades como el cáncer, enfermedades cardiovasculares, trastornos neurológicos y enfermedades virales. Por otro lado, dado el elevado número de genes cuya expresión es regulada por un solo miRNA, estos se consideran dianas terapéuticas especialmente relevantes en enfermedades complejas y multigénicas, ya que regulando un solo miRNA es posible afectar a una ruta concreta en varias partes de la misma por lo que se consigue un efecto teóricamente más potente que modulando un solo gen.
Los fármacos antimiR están diseñados para inhibir la actividad de miRNAs específicos que se encuentran desregulados en enfermedades. Estos tratamientos utilizan moléculas sintéticas, en concreto, oligonucleótidos antisentido, que se unen a los miRNAs diana e impiden su interacción con los mRNAs. Esto permite restablecer la regulación génica normal y ofrece una estrategia terapéutica novedosa y prometedora. Cabe destacar que aunque varias empresas llevan años trabajando para desarrollar fármacos que inhiban la expresión de microRNAs, y varios de ellos han llegado a desarrollarse en fases clínicas, ninguno de ellos ha sido aprobado todavía. Como ejemplos representativos del sector, Regulus Therapeutics en Estados Unidos, se ha especializado en el desarrollo de antimiRs contra enfermedades hepáticas, Cardior en Alemania, está centrada en enfermedades de corazón, Resalis Therapeutics desarrolla antimiRs para tratar enfermedades metabólicas, y Arthex Biotech en España, desarrolla antimiRs contra enfermedades neuromusculares.
Desarrollo preclínico de antimiRs
El desarrollo de antimiRs (en Arthex) sigue un riguroso proceso de optimización y validación para asegurar la selección de los compuestos más efectivos y seguros a la hora de tratar una enfermedad. Este proceso puede aplicarse a cualquier antimiR o patología, y consta de los siguientes pasos.
Para comenzar, se realiza una exhaustiva investigación para comprender la patología de la enfermedad objetivo. Esto incluye identificar las causas genéticas y moleculares que contribuyen a la enfermedad y determinar las proteínas o microRNAs implicados. Luego, se identifica un microRNA específico que está alterado en los pacientes y que desempeña un papel clave en la patología. Este microRNA se convierte en el objetivo terapéutico o diana para el desarrollo del antimiR.
El siguiente paso es el desarrollo de oligonucleótidos, donde se diseña y sintetiza una biblioteca de antimiRs que puedan inhibir el microRNA objetivo. Estos antimiRs son oligonucleótidos modificados químicamente para mejorar su estabilidad y eficacia. La evaluación in vitro incluye la transfección de los antimiRs en células humanas relevantes para la enfermedad, utilizando diferentes concentraciones para evaluar su efecto. Se determinan los valores de actividad (EC50 y Emax) y toxicidad (TC50) para calcular el índice terapéutico, que ayuda a identificar los antimiRs más prometedores. Además, se utiliza una estrategia de cribado doble para evaluar combinaciones de modificaciones químicas y conjugados hidrofóbicos que permitan una mejor entrada a la célula y así medir la actividad biológica y la posible citotoxicidad de los antimiRs. Este tipo de cribado permite identificar los antimiRs más efectivos y menos tóxicos.
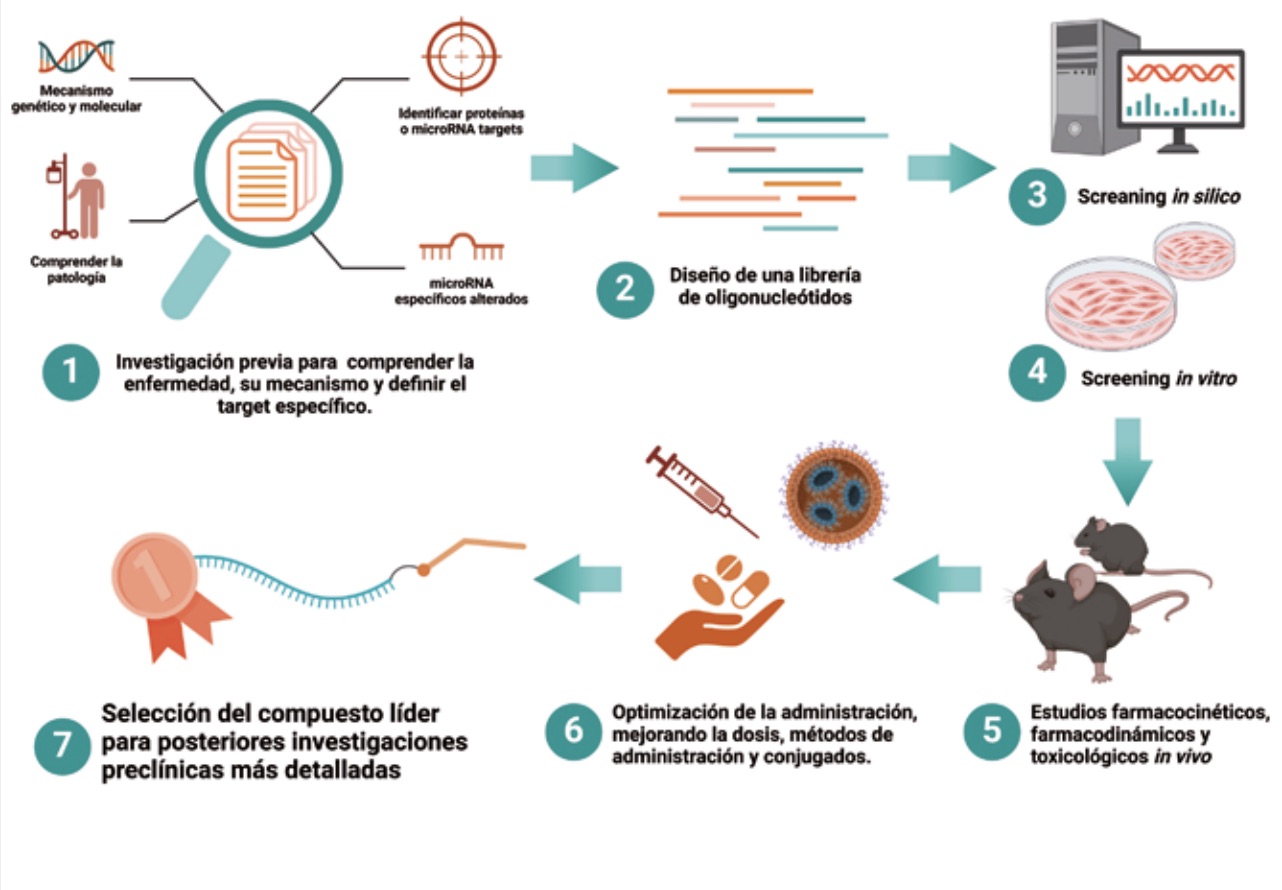
Posteriormente, estos antimiRs seleccionados se administran en modelos animales de la enfermedad para evaluar su impacto terapéutico. Se mide el impacto de los antimiRs en biomarcadores clave de la enfermedad, como niveles de proteínas específicas, fenotipos clínicos o even tos moleculares asociados. Además, se utiliza ELISA y otros métodos para determinar la distribución y cantidad de los antimiRs en diferentes tejidos, evaluando su llegada a los tejidos relevantes y su perfil farmacotóxico.
Por último, la optimización de la administración incluye probar diferentes dosis, tiempos y vías de administración para identificar la forma más efectiva de administrar los antimiRs. Se compara la eficacia de diferentes antimiRs, enfocándose en aquellos con mejores perfiles de biodistribución y durabilidad de efectos. Finalmente, se identifica el compuesto líder basado en su eficacia, seguridad y perfil farmacológico. Esto permite seleccionar un antimiR para avanzar a pruebas preclínicas requeridas por las agencias regulatorias antes de iniciar un ensayo clínico.
A nivel regulatorio los antimiR, como otros oligonucleótidos, no tienen una guía definida por las agencias regulatorias, como la FDA o la EMA. Generalmente se siguen las directrices del Consejo Internacional de Armonización de Requisitos Técnicos para Productos Farmacéuticos de Uso Humano (ICH), en concreto el ICH M3(R2) e ICH S6(R1). La primera está enfocada a pequeñas moléculas (o moléculas de síntesis química) mientras que la segunda es para moléculas biológicas. Los antimiRs son moléculas de síntesis química pero su mecanismo de acción es similar al de un biológico y de ahí radica la complejidad en el desarrollo preclínico regulatorio. Como particularidades especiales cabe destacar la selección de especies relevantes para los estudios preclínicos, porque el mecanismo de acción debe estar conservado en la especie de destino (el ser humano) y en las especies animales donde se testará.
Otro rasgo importante es el estudio de efectos “off-target”, que aunque no esté indicado en las guías, las agencias regulatorias lo requerirán para evaluar y confirmar que no va a existir un efecto no deseado debido a la interacción del antimiR con una diana distinta a la principal. El paquete regulatorio se completa con estudios de farmacocinética y estudios in vitro e in vivo de toxicidad donde se evaluará tanto la toxicidad en el organismo tras la administración como el efecto del antimiR a nivel cardiovascular, respira torio y nervioso. Estos estudios permiten establecer dosis seguras para el ensayo clínico en humanos.
El gran interés de la industria farmacéutica en la investigación y desarrollo de nuevas terapias basadas en oligonucleótidos también tiene su reflejo en el campo de la propiedad industrial. En los últimos años se ha visto un incremento exponencial del número de solicitudes de patentes publicadas relacionadas con oligonucleótidos, como puede verse en la base de datos Espacenet (worldwide.espacenet.com).
Así pues, de manera general es posible proteger las invenciones relacionadas con oligonucleótidos terapéuticos, y dentro de ellos los antimiR, cumpliendo los clásicos criterios de patentabilidad (novedad, actividad inventiva y suficiencia en la descripción). Esto incluye haber demostrado el efecto terapéutico del antimiR en modelos in vivo o in vitro. Sin embargo, hay determinados matices que, aunque se introducen a nivel de los antimiR pueden extrapolarse a cualquier oligonucleótido. En primer lugar, el alcance de la protección puede ser a nivel del antimiR por sí mismo, como un producto, o por su uso terapéutico. La estrategia dependerá de si existe un miRNA diana conocido para la enfermedad sobre la que se está investigando o desarrollando dicho antimiR.
Generalmente, si no se conoce previamente el miRNA diana de la enfermedad, se puede reivindicar el uso terapéutico del antimiR. En casos donde el miRNA diana ya es conocido, la protección se limita a la secuencia específica del antimiR y sus modificaciones químicas, ya que diseñar un antimiR basado en complementariedad de secuencia es relativamente simple.
Además, en países como EE.UU. y Australia, es necesario incluir modificaciones químicas para señalar el carácter sintético del antimiR, lo cual es fundamental para su patentabilidad. Las oficinas de patentes, especialmente la europea, son cada vez más estrictas en estos aspectos.
OLIGOFASTX. Plataforma integral para el desarrollo sostenible de terapias basadas en Oligonucleótidos
OLIGOFASTX es un consorcio multidisciplinar liderado por Sylentis (Grupo PharmaMar) y en el que participan además de Arthex Biotech, otras cuatro empresas españolas, Nanovex Biotechnologies (Grupo Industrial Química del Nalón), AptaTargets, Nostrum Biodiscovery y 53Biologics.
OLIGOFASTX aúna recursos y esfuerzos para crear una plataforma que facilite y contribuya a la generación en España de un tejido industrial biofarmacéutico especializado en el desarrollo de terapias basadas en oligonucleótidos y que tiene el RNA como hilo conductor, contribuyendo al desarrollo acelerado de este tipo de terapias. OLIGOFASTX está financiado por el Centro de Desarrollo Técnico Industrial (CDTI) a través del programa Misiones Ciencia e Innovación, dentro del Plan de Recuperación, Transformación y Resiliencia – Fondos Next Generation EU.
Artículo para Farmabiotec escrito por:
Alba de Paz, Project Manager Arthex Biotech.
Estefanía Cerro, Head of R&D Arthex Biotech.
Nuria Barquero, Head of Non Clinical Development Arthex Biotech.

 English
English
